Einführung von Magnesiumfluorid MgF2
Magnesiumfluorid ist eine anorganische Verbindung mit der Formel MgF2. Die Verbindung ist ein weißes kristallines Salz und ist über einen weiten Wellenlängenbereich transparent und wird kommerziell in der Optik eingesetzt, die auch in Weltraumteleskopen verwendet wird.
Magnesium (Atomsymbol: Mg, Ordnungszahl: 12) ist ein Block S, Gruppe 2, Periode 3-Element mit einer Atommasse von 24,3050. Die Anzahl der Elektronen in jeder der Magnesiumschalen beträgt [2, 8, 2] und seine Elektronenkonfiguration ist [Ne] 3s2. Das Magnesiumatom hat einen Radius von 160 Uhr und einen Van-der-Waals-Radius von 173 Uhr. Magnesium wurde 1775 von Joseph Black entdeckt und erstmals 1808 von Sir Humphrey Davy isoliert. Magnesium ist das achthäufigste Element in der Erdkruste und das vierthäufigste Element auf der Erde insgesamt. Elementares MagnesiumIn seiner elementaren Form hat Magnesium ein glänzendes graues metallisches Aussehen und ist äußerst reaktiv. Es kommt in Mineralien wie Brucit, Carnallit, Dolomit, Magnesit, Olivin und Talk vor. Kommerziell, Magnesium wird hauptsächlich zur Herstellung von starken und leichten Aluminium-Magnesium-Legierungen verwendet, die zahlreiche Vorteile in industriellen Anwendungen bieten. Der Name"Magnesium"stammt aus einem griechischen Bezirk in Thessalien namens Magnesia.
Fluor ist ein Block P, Gruppe 17, Periode 2-Element. Seine Elektronenkonfiguration ist [He]2s22p5. Das Fluoratom hat einen kovalenten Radius von 64 Uhr und sein Van-der-Waals-Radius beträgt 135 Uhr. In seiner elementaren Form, CAS 7782-41-4, hat Fluorgas ein blassgelbes Aussehen. Fluor wurde 1810 von André-Marie Ampère entdeckt. Es wurde erstmals 1886 von Henri Moissan isoliert.
Magnesiumfluorid ist bei 18 sehr unlöslich in Wasser (0,0076 g/100 ml).°C [151]. Es kann mit Wasser agglomeriert, zu grünen Pellets gepresst, entwässert und bei hohen Temperaturen gesintert werden, um poröse Pellets herzustellen, die zum selektiven Einfangen von Technetium verwendet werden können. Eingeschlossenes Technetium kann nicht einfach vom MgF2 desorbiert werden, was Temperaturen über 1000 erfordert°C. Eingeschlossenes Technetium kann jedoch leicht durch Waschen mit Wasser oder verdünnter Salpetersäure entfernt werden. Das Magnesiumfluorid kann nach einem Trocknungsschritt wiederverwendet werden [152]. Magnesiumfluorid wird in großem Maßstab zum selektiven Einfangen flüchtiger Technetiumfluoride und Oxyfluoride von Technetium in Verbindung mit UF6 verwendet [22,152,153].
Magnesiumfluorid (MgF2) enthaltende Beschichtungen wurden auf biologisch abbaubaren Metallen auf Mg-Basis durch chemische Umwandlung mit Flusssäure hergestellt (Chiu, Wong, Cheng & Man, 2007; Lin, Tan, Wan et al., 2013; Pereda et al. , 2010; Thomann et al., 2010; Yan et al., 2010) oder MAO (Pan, Chen, Wang & Lin, 2013; Pan, Chen, Wang & Zhao, 2013; Seyfoori, Mirdamadi, Khavandi & Raufi , 2012) Methoden. Fluor (F) ist ein natürlicher Bestandteil in menschlichen Knochen und Zähnen (Zheng, Wu, Ng, Wang & Lian, 2002). Eine ordnungsgemäße Freisetzung von F wird den Organismen keinen Schaden zufügen (Thomann et al., 2010). Die Knochenreaktion auf Fluorid ist dosisabhängig: Eine niedrig dosierte Freisetzung von F erleichtert die Knochenbildung; eine hohe Dosis führt jedoch zur Bildung von schlecht mineralisiertem Osteoid (Ellingsen, 1995). Somit ist MgF2 ein akzeptables Beschichtungsmaterial,
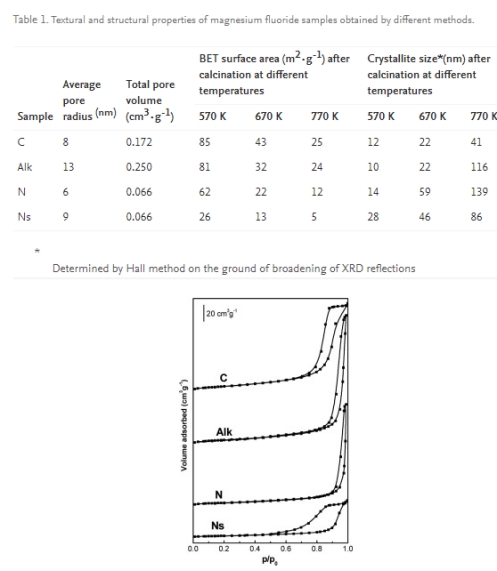
Magnesiumfluorid wurde mit vier verschiedenen Methoden hergestellt, die thermische Behandlung aller Proben war jedoch identisch und bestand in einer Kalzinierung bei 670 K. Trotz der gleichen Kalzinierungstemperatur unterscheiden sich MgF2-Proben erheblich in ihrer porösen Struktur, was sich in der Form der Hystereseschleife widerspiegelt die Isotherme der Niedertemperatur-Stickstoffadsorption, der spezifischen Oberfläche, der Porengröße und des Porenvolumens (Tabelle 1; Abbildung 1). Die größte Fläche (43 m2·g-1) wurde im Fall der Carbonatprobe (C) erhalten, während die kleinste Probe (13 m2·g-1) im Fall von kugelförmigem MgF2, hergestellt aus Magnesiumnitrat (Ns). Die Adsorptions-Desorptions-Isothermen aller Proben sind vom Typ IV, unterscheiden sich jedoch in der Form ihrer Hystereseschleifen. Letztere gehören für die Proben C, Alk und N zum Typ H1, was auf das Vorhandensein zylindrischer Poren hinweist, während die Hystereseschleife der Probe Ns Merkmale von Hystereseschleifen der Typen H1 und H2 vereint, die auftreten, wenn enghalsige Poren vorhanden sind. Die größte Porengröße (r = 13 nm) und das größte Porenvolumen (0,250 cm3).·g-1) wurden in Magnesiumfluorid gefunden, das aus Magnesiumalkoxid (Alk) hergestellt wurde. Die besprochene Probe zeichnet sich auch durch die niedrigste thermische Stabilität aus, was auf eine erhebliche Zunahme der Kristallitgröße und eine drastische Verringerung der Oberfläche mit steigender Kalzinierungstemperatur zurückzuführen ist (Tabelle 1). Den höchsten Widerstand gegen Sinterung und Rekristallisation bei hohen Temperaturen zeigten Karbonat- (C) und Nitrat-Kugelproben (Ns).
Ein Teil des Inhalts dieses Artikels stammt von Science Direct:https://www.sciencedirect.com
FOSHAN NANHAI SHUANGFU CHEMICAL CO., LTD ist eine der Herstellung vonmittel und hochQualitätMagnesiumfluorid,langfristig liefern Produktion und Lieferung dieses Produkts in die ganze Welt.
Achtung:Nicole Huang (Verkaufsleiterin)
Hinzufügen: Qishan Industry Park, Yanfeng Road, Shishan, Bezirk Nanhai, Stadt Foshan, China.
Telefon:86 757 81108788
Handy, Mobiltelefon: 86 13928083637
UND-E-Mail: sales@df-chemicals.com




